Kandungan
- Arahan
- Bilangan elektron dalam lapisan valensi
- Struktur Lewis
- Caj formal bagi setiap atom
- Notis
- Apa yang anda perlukan
Apabila menentukan caj rasmi molekul seperti CoCl2 (gas phosgene), adalah perlu untuk mengetahui bilangan elektron dalam lapisan valensi setiap atom dan struktur molekul Lewis.
Arahan

-
Cari setiap atom dalam jadual berkala unsur-unsur untuk menentukan bilangan elektron dalam lapisan valensi.
-
Ingatlah bahawa dua elektron berada di sub-peringkat pertama, dua di dalam sub-level kedua, enam elektron di p sub peringkat pertama, dan sebagainya. Ingat: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Tekan beban. Sekiranya molekul itu adalah ion, tambah atau tolak satu atau lebih elektron dari jumlah tersebut untuk mencapai caj muktamad.
-
Untuk CoCl2 (gas phosgene): C = 4; O = 6; Cl = 7. Molekul tidak diionisasikan dan mempunyai cas neutral. Oleh itu, jumlah elektron dalam lapisan valensi adalah 4 + 6 + (7x2) = 24.
Bilangan elektron dalam lapisan valensi
-
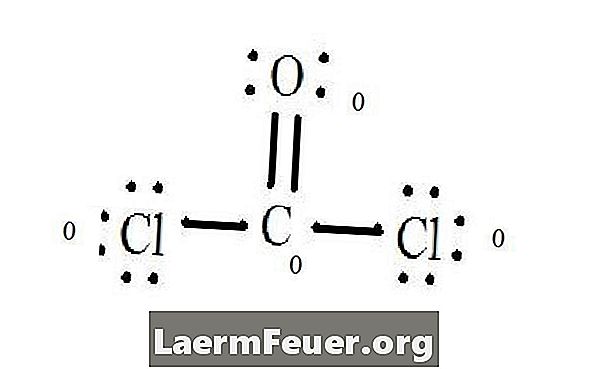
Lihat gambarajah struktur Lewis CoCl2 (gas phosgene). Struktur Lewis mewakili struktur yang paling stabil dan mungkin untuk molekul. Atom ditarik dengan elektron valensi berpasangan; bon terbentuk antara elektron bebas untuk memenuhi peraturan oktet.
-
Lukis setiap atom dan elektron valensinya dan kemudian membentuk ikatan seperti yang diperlukan.
Elektron ditarik pada struktur Lewis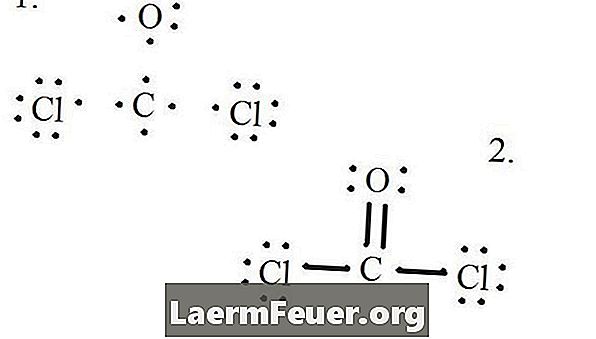
-
Atom klorida berkongsi ikatan tunggal dengan molekul karbon, manakala atom oksigen membentuk ikatan berganda dengan karbon. Setiap atom dalam struktur akhir memenuhi peraturan oktet dan mempunyai lapan elektron dalam lapisan valensi, yang membolehkan kestabilan molekul.
Struktur Lewis
-
Kirakan pasangan elektron bebas setiap atom dalam struktur Lewis. Setiap atom menunjuk elektron setiap ikatan yang mana ia ikut. Tambah nombor ini. Dalam CoCl2: C = 0 pasangan percuma ditambah 4 elektron ikatan = 4 elektron. O = 4 elektron pasangan bebas ditambah 2 elektron bon = 6 elektron. Cl = 6 elektron pasangan bebas ditambah satu elektron satu ikatan dengan C = 7 elektron.
-
Kurangkan bilangan bilangan elektron dalam lapisan valensi pada atom yang tidak terikat. Hasilnya adalah caj rasmi untuk setiap atom. Di dalam CoCl2: C = 4 elektron valensi (ev) dalam atom yang tidak terhingga tolak 4 elektron yang ditetapkan dalam struktur Lewis (LS) = 0 charge formal O = 6 ev - 6 LS = 0 caj rasmi
Caj formal atom
-
Apabila menulis, letakkan caj ini berhampiran atom dalam struktur Lewis. Jika secara keseluruhan molekul mempunyai caj, letakkan struktur Lewis dalam kurungan dengan penulisan yang ditulis di luar di sudut kanan atas.
Caj formal bagi setiap atom
Notis
- Pengiraan cas rasmi untuk molekul yang mengandungi logam peralihan boleh menjadi khianat. Bilangan elektron dalam lapisan valensi untuk logam peralihan adalah dari pola gas mulia.
Apa yang anda perlukan
- Jadual berkala unsur-unsur